纳升级精准检测!I.DOT助力MoS₂-DMA平台实现多病毒核酸同步筛查
引言
病毒核酸的多重检测是早期感染筛查的关键,但传统方法(如PCR、抗体检测)存在样本用量大(微升级)、通量低、难以同时区分多种病毒(如HIV-1/HIV-2共感染)的痛点[1,2]。droplet microarray(DMA)平台凭借超微量反应特性,结合二硫化钼(MoS₂)纳米片的荧光淬灭能力,为解决这一难题提供了新思路。本研究开发“MoS₂修饰树枝状大分子液滴微阵列(MoS₂-DMA)”传感平台,通过I.DOT非接触式纳升级移液技术精准控制液滴打印,基于荧光共振能量转移(FRET)机制,实现150 nL样本量下HIV-1/HIV-2核酸的同步检测,还可扩展至SARS-CoV-2、流感A等5种病毒基因的筛查,检测限(LOD)低至50pM,为临床快速、高通量病毒筛查提供了革新性工具。
实验方法
1、核心平台与传感体系设计
采用7.5×2.5cm玻璃载玻片,通过树枝状大分子修饰构建“疏水性边界-亲水性斑点”DMA芯片(含14 × 14个1 mm × 1 mm亲水斑点,间距0.5 mm,图1a)。以MoS₂纳米片为FRET淬灭剂(acceptor),FAM标记的HIV-1探针、Cy5标记的HIV-2探针为荧光供体,构建“关-开”型传感体系;同时可扩展至SARS-CoV-2(ORF1ab、N基因)、流感A(M基因)的检测,通过多色荧光与空间分区实现多重筛查。
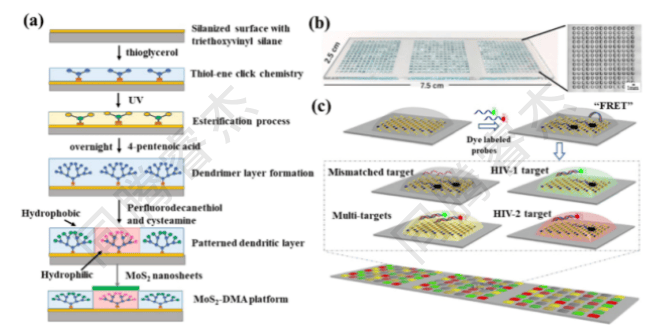
图1. (a) 基于表面上具有亲水型斑点阵列的图案化树枝状载玻片的MoS2-DMA传感平台的制造工艺。(b)在所制备的MoS2-DMA平台上形成的液滴阵列;液滴的体积为150 nL。(c)以检测HIV-1和HIV-2DNA序列为例,MoS2-DMA平台用于同时检测多个目标探针的传感机制。
实验操作与I.DOT核心应用
MoS₂涂层制备:通过I.DOT将100 nL浓度为200 μg/mL的MoS₂悬液(乙醇/水=8:2)精准打印至DMA亲水斑点,室温放置1-2天干燥,形成60-100 nm厚的MoS₂纳米层(图1a流程,图2e-f)。I.DOT的精准分配确保每个斑点的MoS₂负载量均一,为后续淬灭效率稳定奠定基础。
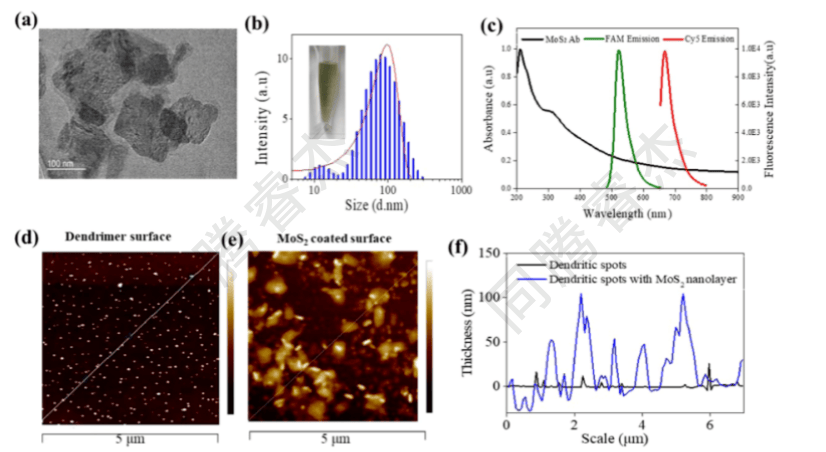
图2.(a)MoS2纳米片的电子显微镜图像,(b)动态光散射(DLS)测量的MoS2纳米片的尺寸分布,(c)MoS2纳米片的UV-Vis吸光度以及FAM和Cy5染料的荧光发射光谱,(d)半胱胺修饰的树枝状大分子斑点表面的原子力显微镜图像,(e)MoS2纳米片状斑点表面的原子力显微镜图像,以及(f)半胱胺修饰的树枝状大分子斑点表面和MoS2纳米片状涂层斑点表面的表面轮廓。
FRET传感体系构建:使用I.DOT打印150 nL浓度为50 nM的荧光探针溶液(FAM-HIV-1或Cy5-HIV-2,混合检测时各25 nM)到MoS₂涂层斑点,在控湿暗室孵育1h,探针通过范德华力吸附于MoS₂表面,荧光被淬灭(图3b、图4a)。
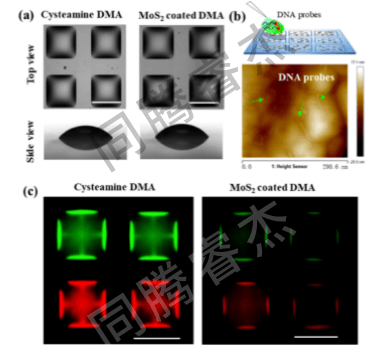
图3. (a) 非接触式液体移液技术在胱胺修饰(左)和MoS₂纳米片涂层(右)位点上形成的150纳升液滴形态示意图。(b) 在MoS₂纳米片涂层位点表面打印荧光标记捕获探针以构建FRET传感系统的方案图,以及吸附在MoS₂纳米片涂层位点表面的荧光标记捕获探针的原子力显微镜(AFM)图像。(c) 胱胺DMA与MoS₂纳米片涂层DMA表面标记捕获探针的荧光成像对比图。上述图像的比例尺均为1毫米。
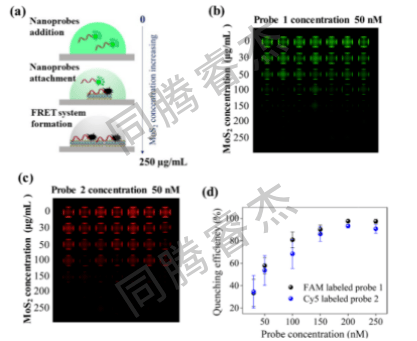
图4. (a) 荧光标记捕获探针与MoS₂纳米片调控比例示意图,用于实现最佳猝灭效率。荧光标记探针(50 nM)在150 nL液滴中孵育,液滴分布于经不同浓度(0−250 μg/mL)MoS₂纳米片修饰的100 nL亲水位点表面。(b) FAM标记捕获探针-1(50 nM)在系列浓度MoS₂纳米片包覆亲水位点的荧光成像图。(c) Cy5标记捕获探针-2(50 nM)在系列浓度MoS₂纳米片包覆亲水位点的荧光成像图。(d) 两种荧光标记探针(捕获探针-1和捕获探针-2)在MoS₂纳米片梯度浓度修饰位点的猝灭效率对比。
样本检测与信号读取:通过I.DOT将150 nL靶标溶液(HIV或其他病毒基因,浓度10-50nM)打印至传感斑点,37℃暗室孵育1h;靶标与探针特异性杂交形成双链,导致探针与 MoS₂表面的亲和力减弱,从而脱离 MoS₂表面,荧光恢复(“开”状态);使用荧光显微镜(KeyenceBZ-9000)分别在488nm(FAM)和668nm(Cy5)激发下检测信号(图1c机制,图5a/b检测流程)。
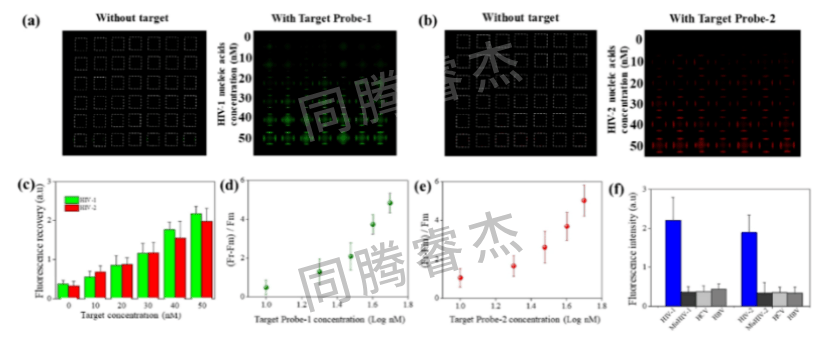
图5. (a) MoS₂-DMA FRET传感平台在目标探针-1(浓度范围10至50 nM)存在下的荧光强度变化.(b) MoS₂-DMA FRET传感平台在目标探针-2(浓度范围10至50 nM)存在下的荧光强度变化(c) 传感位点荧光强度与目标探针浓度的定量分析关系.(d) 相对荧光恢复率随目标探针-1对数浓度变化的曲线图.(e) 相对荧光恢复率随目标探针-2对数浓度变化的曲线图.(f) MoS₂-DMA FRET传感平台对HIV-1/HIV-2目标探针的特异性测试(使用四碱基错配探针、HBV探针及HCV探针作为对照).
实验结果
1、平台基础验证:
I.DOT 保障体系均一性与稳定性
MoS₂纳米片特性:经超声剥离的MoS₂平均粒径90nm,UV-Vis吸收覆盖UV至近红外,与FAM(520 nm)、Cy5(670 nm)的发射光谱高度重叠,满足FRET能量转移需求(图2a-c);通过I.DOT打印涂层后,亲水斑点表面形成均匀的MoS₂纳米层,厚度60-100 nm(图2e-f),多次清洗后仍稳定附着。
液滴与淬灭效率:I.DOT打印的150 nL液滴在亲水斑点上几何稳定(图3a),无明显蒸发(24h体积变化<5%);MoS₂对荧光探针的淬灭效率随浓度升高而提升,当I.DOT打印“100 nL 200 μg/mLMoS₂+150 nL 50 nM探针”时,淬灭效率>95%,为低背景检测提供保障(图4d)。
2、HIV 单靶标检测:
高灵敏与高特异性
灵敏度:当靶标浓度为10-50 nM时,荧光强度随浓度升高呈线性增长,HIV-1、HIV-2的LOD分别为1.24 nM和1.26 nM;结合微型光电探测器优化后,LOD可进一步降至50 pM(图5a-e),远低于临床感染阈值。
特异性:四碱基错配探针、HBV/HCV靶标均未引发明显荧光恢复,信号强度仅为HIV靶标的1/5-1/6,证明平台可特异性区分目标病毒(图5f)。
3、HIV 双靶标同步检测:
空间分区实现精准区分
设计4 × 4DMA阵列,分为HIV-1检测区、HIV-2检测区、两者混合区及阴性对照区(图6a)。I.DOT打印的混合样本(HIV-125nM+HIV-225 nM)在混合区呈现黄色荧光(FAM绿色与Cy5红色叠加),而单一靶标区仅对应单色荧光(图6b);6次重复实验的相对荧光强度(RFI)变异系数<5%,证明检测稳定性(图6c)。
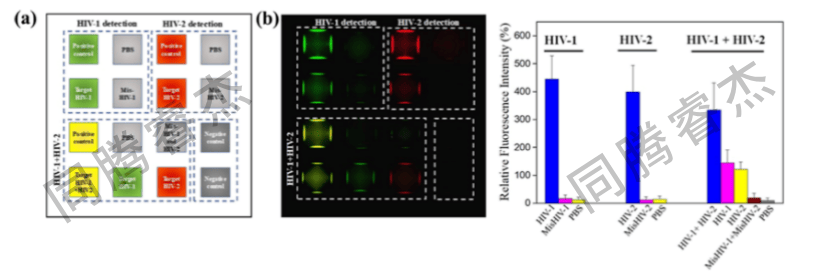
图6. (a) MoS₂-DMA传感平台检测HIV-1/HIV-2核酸的示意图.(b) MoS₂液滴微阵列检测HIV-1/HIV-2核酸的荧光显微图像(滴液标识参见(a)).(c) 双重HIV-1/HIV-2核酸检测平台的重复性实验分析误差棒表示相对荧光强度(RFI)±标准差(P < 0.001:针对HIV-1、HIV-2及HIV-1/HIV-2混合样本的目标探针检测;P > 0.05:针对错配核酸的检测。采用学生氏非配对双尾t检验,n = 6)
4、多病毒基因筛查:
扩展至 5 种靶标的多重检测
利用 “多色荧光+空间分区” 策略,该平台成功检测 5 种病毒基因:HIV-1、HIV-2、SARS-CoV-2 ORF1ab、SARS-CoV-2 N、流感 A M 基因。不同基因的荧光信号随浓度(0.5-10 nM)升高而增强,且无交叉干扰,证明其在多病毒共感染筛查中的应用潜力(图7)。
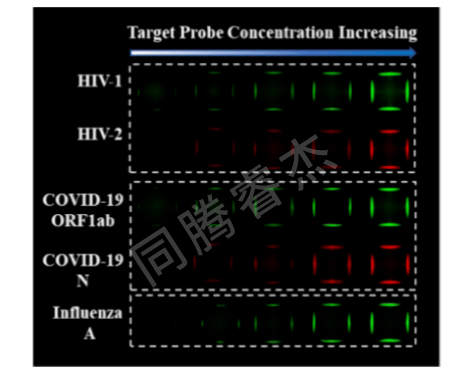
图7. MoS2-DMA FRET传感平台,用于检测不同病毒的五个基因靶标探针。
总结与讨论
本研究开发的MoS₂-DMA FRET传感平台,通过I.DOT非接触式纳升级移液技术实现了病毒核酸检测“超微量、高通量、多重化”的突破,其核心价值显著:作为纳升级液滴精准分配的核心工具,I.DOT可实现“100 nL MoS₂悬液-150 nL荧光探针-150 nL样本”的均一打印,解决了传统手动加样的体积误差(±5%vs±20%),是该平台淬灭效率优化(>95%)、检测重复性(CV<5%)和多重筛查准确性的关键支撑;同时,相比传统方法,该平台具备显著综合优势,样本用量仅150 nL(为96孔板的1/300),单芯片含588个独立斑点以实现高通量检测,检测限(LOD)低至50pM且可特异性区分错配序列与其他病毒,还能通过多色荧光与空间分区实现5种以上病毒基因的同步检测,完美契合临床快速筛查需求;
此外,平台应用前景广阔,目前已验证对HIV、SARS-CoV-2、流感A的检测能力,未来结合等温扩增技术可进一步将灵敏度提升至fM级,还可拓展至乙肝、丙肝等更多病原体检测,为突发传染病应急检测、临床多病毒共感染诊断提供“一站式”解决方案。可见,I.DOT与MoS₂-DMA的协同作用,不仅革新了病毒核酸检测的微型化路径,更推动了“纳升级高通量传感”在临床诊断中的落地,为精准医疗提供了重要技术支撑。
