JC-1线粒体膜电位检测
一、JC-1检测原理
JC-1(又称CBIC2(3))是一种检测线粒体膜电位(△Ψm)的荧光探针,分子式为C25H27Cl4IN4,分子量652.23,CAS号为3520-43-2,纯度高于95%。该物质广泛应用于细胞、组织或纯化线粒体的膜电位检测。
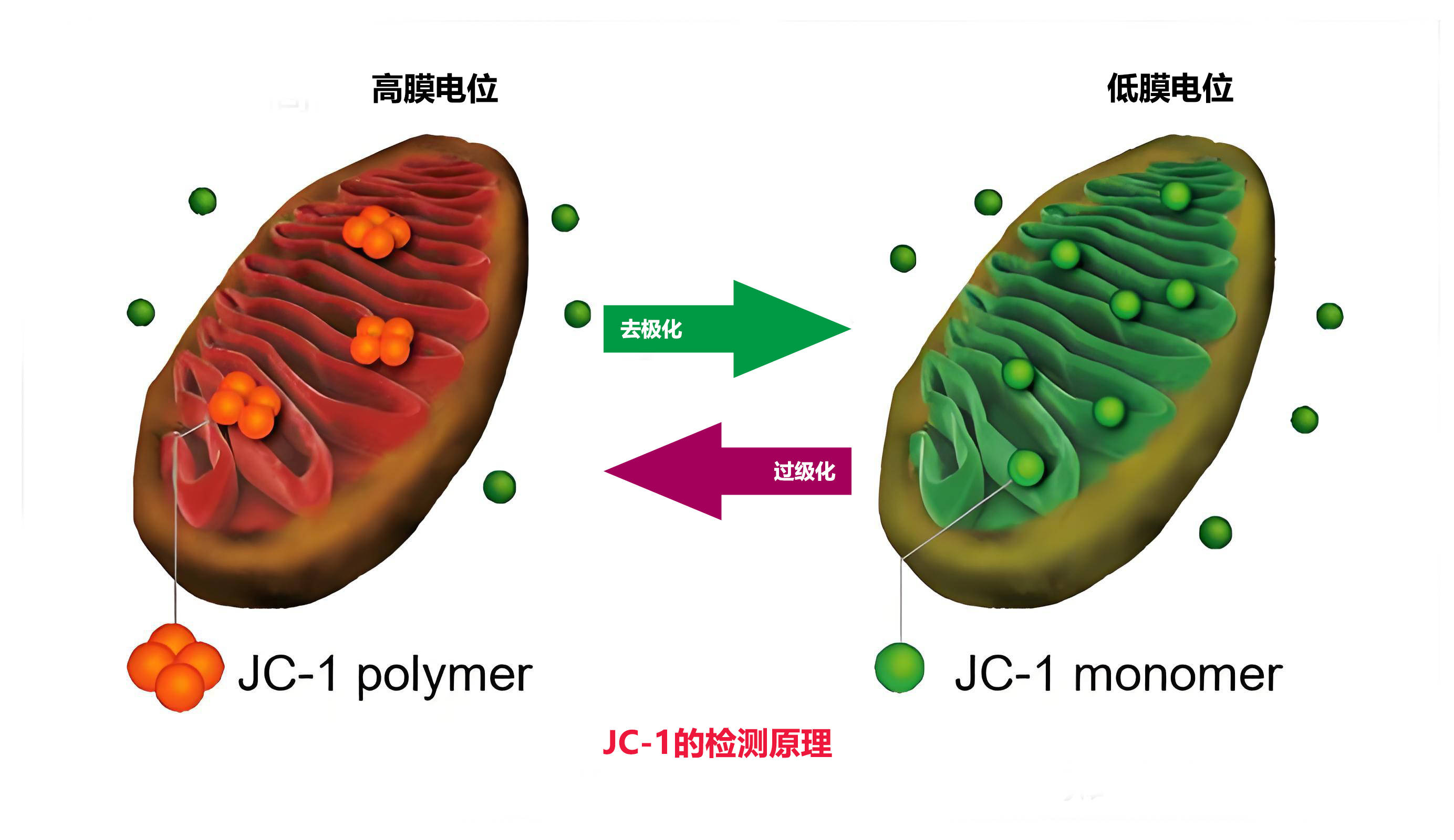
JC-1通过荧光颜色变化反映线粒体膜电位状态:高电位时在线粒体基质中聚合形成J-聚集体发出红色荧光(激发/发射波长585/590nm),低电位时以单体形式存在发出绿色荧光(激发/发射波长514/529nm)。其红绿荧光强度比可作为线粒体去极化程度的指标,常用于检测细胞凋亡早期因膜电位下降引发的荧光转变。该特性使其成为研究线粒体功能和细胞凋亡机制的重要工具。
线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。通过JC-1从红色荧光到绿色荧光的转变可以很容易地检测到细胞膜电位的下降,同时也可以用JC-1从红色荧光到绿色荧光的转变作为细胞凋亡早期的一个检测指标。
二、JC-1线粒体膜电位检测实验流程
1、实验前准备
(1)材料与试剂
l JC-1探针、培养基、试剂盒、超纯水
l JC-1染色缓冲液、PBS缓冲液等。
(2)设备
l 荧光显微镜(具备488 nm激发光,能检测530 nm和590 nm荧光)、流式细胞仪(设置488 nm激发光,FL-1通道检测530 nm绿色荧光,FL-2通道检测590 nm红色荧光)、温控设备(37℃培养箱)、移液器
(3)细胞准备
l 确保细胞处于对数生长期,以获得最佳的膜电位状态。
2、实验步骤
(1)JC-1染色工作液的配制
l 按照试剂盒说明,将JC-1探针用DMSO溶解,再用无血清培养基稀释至所需浓度(通常2.5-10 µg/mL)。
l 六孔板每孔需1 mL染色工作液,细胞悬液每50-100万细胞需0.5 mL染色工作液。
确保JC-1充分溶解并混匀。
(2)细胞染色
l 将适量JC-1工作液加入细胞培养基中,轻轻混匀。
l 将细胞板置于37℃、5% CO₂培养箱中孵育15-30分钟(根据细胞类型调整)。
l 染色结束后,用预冷的PBS洗涤细胞2-3次,去除未结合的探针。
(3)细胞处理
l 对于贴壁细胞,可用胰蛋白酶轻微处理后收集细胞悬液。
l 对于悬浮细胞,按照步骤进行重悬、孵育、离心和洗涤。
l 最后用JC-1染色缓冲液重悬细胞,准备检测。
(4)检测与数据采集
l 荧光显微镜检测:观察细胞,设置激发波长488 nm,红色荧光发射波长590 nm,绿色荧光发射波长530 nm。健康细胞呈现红色荧光,受损细胞呈现绿色荧光。
l 流式细胞仪检测:测量细胞群体的红绿荧光比例,计算红/绿荧光比值以评估线粒体膜电位的变化。
3、结果分析
l 通过软件分析生成红/绿荧光比值图表。
l 流式细胞仪检测时,FL-1+、FL-2+为正常细胞,FL-1+、FL-2-为凋亡细胞。
三、注意事项
1、JC-1的溶解和保存:
l JC-1在低温下会凝固,需在20-25℃水浴中溶解后再使用。
l 染色完成后,尽量在30分钟内完成检测,未使用的染色液需冰浴保存。
2、操作条件:
l 染色过程中保持37℃,避免温度波动。
l 洗涤时,JC-1染色缓冲液保持4℃左右,以获得更好的洗涤效果。
3、实验重复性和可靠性:
l 避免外界因素(如pH变化、温度波动)对细胞的影响。
l 确保JC-1染色缓冲液的pH一致性。
4、安全与补偿调节:
l 使用CCCP(线粒体电子传递链抑制剂)时需注意防护。
l 流式细胞仪检测时,注意补偿调节,可使用补偿微球或FITC/PE染料抗体进行校准。
四、常见问题与解答:
1、组织样本可不可以用JC-1检测凋亡?
可以,但无法直接检测组织,可先将组织制备成单细胞悬液,再按照悬浮细胞的操作步骤来检测,另外需注意制备单细胞悬液的过程易对细胞造成损伤,需对制备方案进行摸索,避免因消化细胞引起线粒体膜电位变化而导致假阳性;也可提取组织中的线粒体,再孵育JC-1,用荧光酶标仪检测实验结果。
2、贴壁细胞能否直接用JC-1在6孔板染色后,再用胰酶消化下来上流式?
不建议,贴壁细胞之间相互接触可能会导致细胞与染料接触不均一,对JC-1染料进入细胞造成影响,尤其是当细胞生长较为密集的时候。推荐消化细胞后再孵育JC-1。
3、石蜡切片和冰冻切片可以做JC-1吗?
不可以,JC-1实验的样本必须是活细胞。
4、JC-1孵育完成后不能及时检测,可以固定后再检测吗?
不可以,JC-1用于活细胞样本的检测,固定后细胞死亡;此外,染色后放置过久会导致荧光淬灭,建议染色30 min内完成检测。
武汉恩玑生命科技有限公司(EnkiLife)是一家深耕生命科学,专注细胞生物学和免疫学科研试剂的研发、生产与销售的生物技术企业,在全球100多个国家和地区开展业务,致力于为科研工作者提供高质量的产品和卓越的客户服务,推动生命科学的发展。

